Una svolta nell’agricoltura cellulare, che consentirà alle cellule bovine di produrre i propri fattori di crescita, promette significative riduzioni dei costi nella produzione di carne coltivata. Questo progresso potrebbe portare ad alternative alla carne convenienti e sostenibili nei supermercati, con la ricerca in corso focalizzata sull’ottimizzazione per l’uso commerciale e l’approvazione normativa.
Le cellule muscolari bovine sono state progettate per generare i propri segnali di crescita
L’agricoltura cellulare – la produzione di carne da cellule coltivate in bioreattori anziché raccolte da animali da allevamento – sta facendo passi da gigante nella tecnologia che la rendono un’opzione più praticabile per l’industria alimentare. Uno di questi progressi è stato compiuto presso il Tufts University Center for Cellular Agriculture (TUCCA), guidato da David Kaplan, professore di ingegneria della Stern Family, in cui i ricercatori hanno creato cellule muscolari bovine (manzo) che producono i propri fattori di crescita, un passo avanti che può ridurre significativamente i costi di produzione.
I fattori di crescita, utilizzati negli esperimenti di laboratorio o per la carne coltivata, si legano ai recettori sulla superficie cellulare e forniscono alle cellule il segnale che è ora di crescere e differenziarsi in cellule mature di diverso tipo. In questo studio pubblicato sulla rivista Cell Reports Sustainability, i ricercatori hanno modificato le cellule staminali per produrre il proprio fattore di crescita dei fibroblasti (FGF) che innesca la crescita delle cellule muscolari scheletriche, del tipo che si trova in una bistecca o in un hamburger.
“L’FGF non è esattamente un nutriente”, ha affermato Andrew Stout, allora ricercatore capo del progetto e ora direttore scientifico presso il Tufts Cellular Agriculture Commercialization Lab. “È più come un’istruzione alle cellule di comportarsi in un certo modo. Ciò che abbiamo fatto è stato progettare cellule staminali muscolari bovine per produrre questi fattori di crescita e attivare le stesse vie di segnalazione”.
Carne coltivata: riduzione dei costi e progresso della ricerca
Finora i fattori di crescita dovevano essere aggiunti al liquido o al mezzo circostante. Realizzati a partire da proteine ricombinanti e venduti da fornitori industriali, i fattori di crescita contribuiscono alla maggior parte del costo di produzione della carne coltivata (fino o oltre il 90%). Poiché i fattori di crescita non durano a lungo nei terreni di coltura cellulare, devono essere reintegrati ogni pochi giorni. Ciò limita la capacità di fornire un prodotto conveniente ai consumatori. Togliere questo ingrediente dai terreni di crescita porterebbe ad un enorme risparmio sui costi.
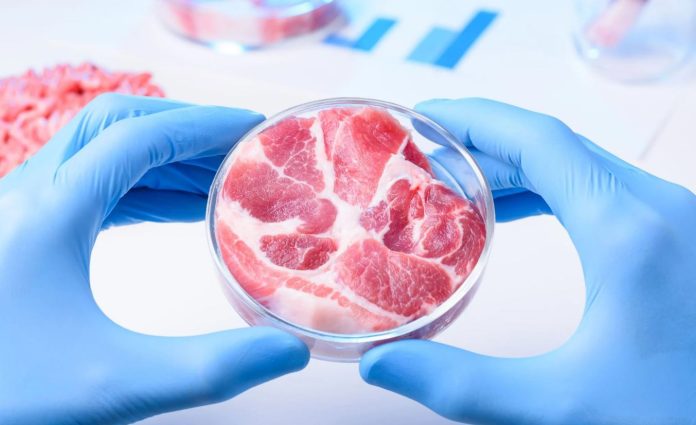
Le cellule muscolari bovine coltivate per la carne producono i propri fattori di crescita, rimuovendo un ingrediente costoso dal mezzo di crescita liquido. Crediti: Alonso Nichols, Tufts University
Stout sta guidando diversi progetti di ricerca presso il Cellular Agriculture Commercialization Lab della Tufts University, uno spazio incubatore tecnologico creato per portare le innovazioni dell’università e svilupparle al punto in cui possano essere applicate su scala industriale in un contesto commerciale.
“Anche se in questo modo si riducono significativamente i costi, c’è ancora qualche ottimizzazione da fare prima che la carne coltivata sia pronta per l’industria“, ha affermato Stout. “Abbiamo notato una crescita più lenta con le cellule ingegnerizzate, ma penso che possiamo superare questo problema”.
Le strategie per superare il problema possono includere la modifica del livello e dei tempi di espressione dell’FGF nella cellula o l’alterazione di altri percorsi di crescita cellulare. “In questa strategia, non aggiungiamo geni estranei alla cellula, ma modifichiamo ed esprimiamo semplicemente i geni che sono già presenti” per vedere se possono migliorare la crescita delle cellule muscolari per la produzione di carne.
Questo approccio potrebbe anche portare a un’approvazione normativa più semplice del prodotto alimentare finale, poiché la regolamentazione è più rigorosa per l’aggiunta di geni estranei rispetto alla modifica di geni nativi.
Direzioni future e implicazioni
La strategia funzionerà con altri tipi di carne, come pollo, maiale o pesce? Stout la pensa così: “Tutte le cellule muscolari e molti altri tipi di cellule in genere si affidano all’FGF per crescere“. Prevede che l’approccio verrà applicato ad altre carni, anche se potrebbe esserci variabilità affinché i migliori fattori di crescita si esprimano nelle diverse specie.
“Il lavoro al TUCCA e altrove va avanti per migliorare la tecnologia della carne coltivata”, ha affermato Kaplan, “compresa l’esplorazione di modi per ridurre il costo dei nutrienti nei substrati di crescita e il miglioramento della consistenza, del gusto e del contenuto nutrizionale della carne. I prodotti hanno già ottenuto l’approvazione normativa per il consumo negli Stati Uniti e in altri paesi nel mondo, anche se i costi e la disponibilità rimangono limitati. Penso che progressi come questo ci porteranno molto più vicini a vedere carne coltivata a prezzi accessibili nei nostri supermercati locali entro i prossimi anni”.
Riferimento: “Engineered autocrine signaling eliminates muscle cell FGF2 requirements for cultured meat production” di Andrew J. Stout, Xiaoli Zhang, Sophia M. Letcher, Miriam L. Rittenberg, Michelle Shub, Kristin M. Chai, Maya Kaul e David L. Kaplan , 26 gennaio 2024, Cell Reports Sostenibilità .
DOI: 10.1016/j.crsus.2023.100009