I ricercatori del CNIO hanno scoperto il ruolo essenziale dei retrovirus endogeni nello sviluppo embrionale, in particolare nel passaggio dalla totipotenza alla pluripotenza. Questo studio, che ha sfidato la precedente nozione di “DNA spazzatura”, ha fatto luce sulla relazione simbiotica tra i geni virali e lo sviluppo embrionale iniziale, con implicazioni per la medicina rigenerativa.

Tutti gli animali si sono evoluti grazie ad alcuni virus che hanno infettato organismi primitivi centinaia di milioni di anni fa. Il materiale genetico virale è stato integrato nel genoma dei primi esseri multicellulari ed è ancora oggi nel nostro DNA. I ricercatori del CNIO (Centro nazionale spagnolo per la ricerca sul cancro), hanno descritto per la prima volta il ruolo svolto da questi microrganismi in un processo assolutamente vitale per il nostro sviluppo, e che avviene poche ore dopo la fecondazione: la transizione alla pluripotenza, quando l’ovocita passa da due a quattro cellule.
Prima di questo passaggio ciascuna delle due cellule dell’embrione è totipotente, cioè può svilupparsi all’interno di un organismo indipendente. Le quattro cellule dello stadio successivo non sono totipotenti ma sono pluripotenti, perché possono differenziarsi in cellule di qualsiasi tessuto specializzato del corpo.
Sergio de la Rosa e Nabil Djouder, rispettivamente primo autore e autore senior, ritengono che la scoperta sia stata rilevante per il campo della medicina rigenerativa e della creazione di embrioni artificiali, poiché apre un nuovo modo per generare linee cellulari stabili nelle fasi di totipotenza. Djouder guida il gruppo Fattori di crescita, nutrienti e cancro del CNIO.

Siamo all’8% retrovirus
Il materiale genetico degli attuali cosiddetti “retrovirus endogeni” è stato integrato nei genomi di organismi che potrebbero essere stati i motori dell’esplosione del Cambriano, un periodo avvenuto più di 500 milioni di anni fa in cui i mari del mondo hanno subito un boom della biodiversità. Negli ultimi dieci anni, è stato scoperto che le sequenze genetiche di questi virus costituiscono almeno l’8-10% del genoma umano.
De la Rosa ha spiegato: “Fino a poco tempo fa, questi resti virali sono stati considerati ‘DNA spazzatura’, materiale genetico inutilizzabile o addirittura dannoso. Intuitivamente si pensava che avere virus nel genoma non potesse essere una cosa positiva. Tuttavia, negli ultimi anni abbiamo iniziato a renderci conto che questi retrovirus, che si sono coevoluti con noi nel corso di milioni di anni, hanno funzioni importanti, come la regolazione di altri geni”.
Annuncio pubblicitario
Interessato all'Intelligenza Artificiale?
Prova a leggere su Amazon Unlimited la nostra guida su come installarne una in locale e come ricavarne il massimo.
Una Intelligenza Artificiale locale ti permette di usufruire di tutti i vantaggi derivanti dall'uso dell'IA ma senza dover pagare costosi abbonamenti.
 Leggi la guida su Amazon
Leggi la guida su Amazon
La ricerca pubblicata su Science Advances, ha mostrato che il retrovirus endogeno MERVL determina il ritmo dello sviluppo embrionale, soprattutto durante la fase specifica del passaggio dalla totipotenza alla pluripotenza, e ha spiegato il meccanismo che fa sì che questo accada.
Djouder ha dichiarato: “Si tratta di un ruolo totalmente nuovo per i retrovirus endogeni”. Abbiamo scoperto un nuovo meccanismo che spiega come un retrovirus endogeno controlla direttamente i fattori di pluripotenza”.
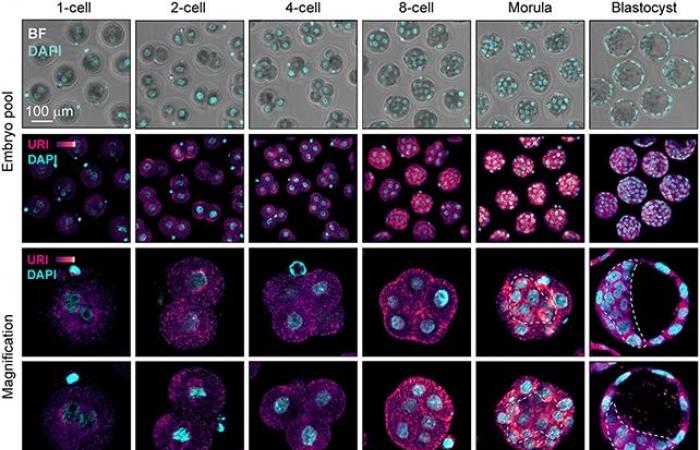
Questo nuovo meccanismo d’azione coinvolge l’URI, un gene su cui il gruppo di Djouder sta studiando in modo approfondito. Anni fa si è stato scoperto che se l’URI viene cancellato negli animali da laboratorio, gli embrioni non riescono nemmeno a svilupparsi. De la Rosa ha voluto scoprire perché e come è collegato con il retrovirus MERVL.
I risultati hanno mostrato che una delle funzioni dell’URI è quella di consentire l’azione di molecole essenziali per acquisire pluripotenza; se l’URI non agisce, non agiscono nemmeno i fattori di pluripotenza e la cellula rimane in uno stato di totipotenza, quindi risulta essere una proteina endogena del retrovirus, MERVL-gag, che modula l’azione dell’URI.
I ricercatori hanno scoperto che durante la fase di totipotenza, quando ci sono solo due cellule nell’ovocita, l’espressione della proteina virale MERVL-gag è elevata; questa si lega all’URI e gli impedisce di agire. Tuttavia, i livelli cambiano gradualmente, in modo che MERVL-gag diminuisce e l’URI entra in azione.
Come ha spiegato De la Rosa: “È una transizione graduale. Quando c’è un’elevata espressione della proteina virale, ci sono meno fattori di pluripotenza; man mano che l’espressione di ERV diminuisce, l’URI stabilizza tali fattori”.
In altre parole, la relazione a tre vie tra proteina virale, URI e fattori di pluripotenza è finemente modulata, “Per concedere tempo sufficiente all’embrione di regolare e coordinare la transizione graduale dalla totipotenza alla pluripotenza e la specificazione del lignaggio cellulare durante lo sviluppo embrionale”, ha concluso Djouder.



