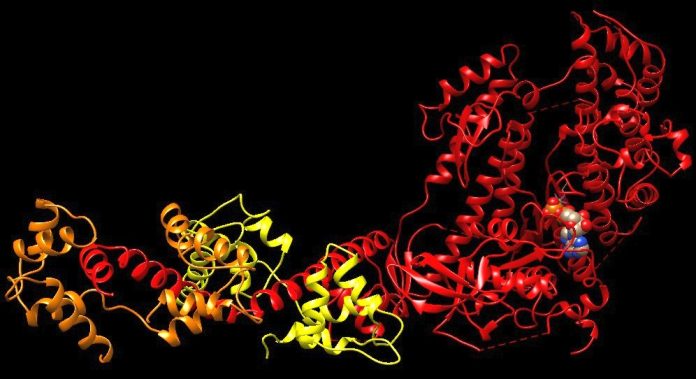
I ricercatori del Max Plank di Dortmund hanno rivelato i meccanismi molecolari mediante i quali le proteine della formina a forma di anello facilitano la crescita dei filamenti di actina nelle cellule.
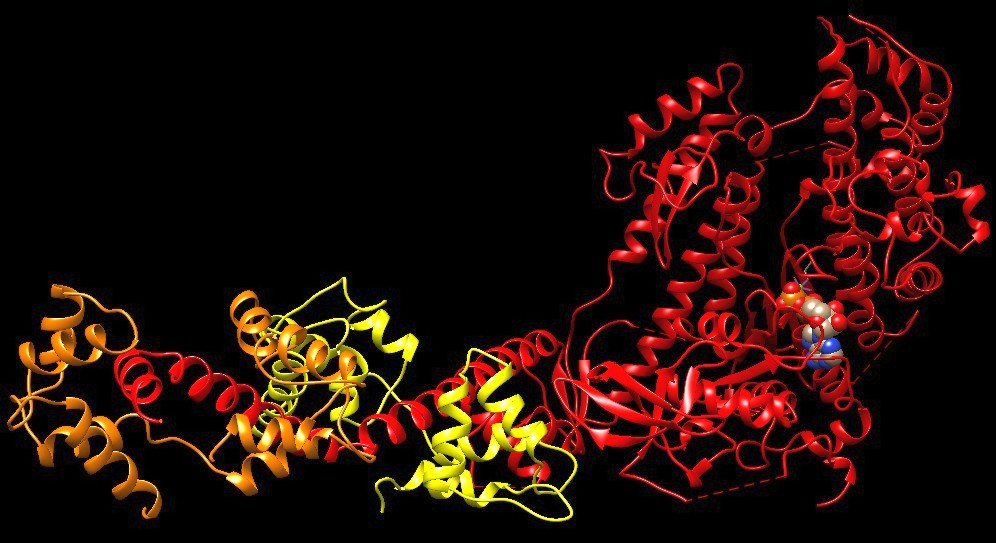
Come le formine si legano alle estremità dei filamenti di actina
L‘actina è una proteina molto abbondante che controlla la forma e il movimento di tutte le nostre cellule. L’actina raggiunge questo obiettivo assemblandosi in filamenti, una molecola di actina alla volta.
Le proteine della famiglia delle formine sono partner fondamentali in questo processo: posizionate all’estremità del filamento, la formina recluta nuove subunità di actina e rimane associata all’estremità “camminando” con il filamento in crescita.
Nelle nostre cellule sono presenti fino a 15 forme diverse che guidano la crescita dei filamenti di actina a velocità diverse e per scopi diversi. Tuttavia, l’esatto meccanismo d’azione della formina e la base dell sua diversa velocità intrinseca è rimasto sfuggente.
Per la prima volta, i ricercatori dei gruppi di Stefan Raunser e Peter Bieling dell’Istituto Max Planck di fisiologia molecolare di Dortmund hanno visualizzato a livello molecolare come le formine si legano alle estremità dei filamenti di actina.
Annuncio pubblicitario
Interessato all'Intelligenza Artificiale?
Prova a leggere su Amazon Unlimited la nostra guida su come installarne una in locale e come ricavarne il massimo.
Una Intelligenza Artificiale locale ti permette di usufruire di tutti i vantaggi derivanti dall'uso dell'IA ma senza dover pagare costosi abbonamenti.
📘 Leggi la guida su Amazon
Questo ha permesso loro di scoprire come la formina medii l’aggiunta di nuove molecole di actina a un filamento in crescita. Inoltre, gli studiosi hanno chiarito le ragioni delle diverse velocità con cui le diverse formine promuovono questo processo.
I ricercatori dell’MPI hanno utilizzato una combinazione di strategie biochimiche e criomicroscopia elettronica (crio-EM). La scoperta, pubblicata sulla rivista Science, può aiutarci a spiegare perché alcune mutazioni nella formina possono portare a malattie neurologiche, immunitarie e cardiovascolari.
“La nostra scoperta ci consente di interpretare decenni di studi biochimici sulle formine attraverso nuove lenti, il che risponde a molte domande aperte da tempo in questo campo“, ha dichiarato Peter Bieling.
Precedenti strutture ottenute dalla cristallizzazione a raggi X hanno rivelato che la formina è costituita da due parti identiche che circondano il filamento di actina in una conformazione ad anello e lo percorrono man mano che cresce. Nei modelli speculativi suggeriti finora, la formina interagisce attraverso tutti i loro quattro domini di legame con l’actina, mentre la formina lenta e quella che si muove velocemente adotterebbero forme diverse sul filamento.
“In questi studi mancavano strutture ad alta risoluzione delle formine legate ai loro siti di attività rilevanti, l’estremità spinata dei filamenti di actina“, ha spiegato Wout Oosterheert, ricercatore nel gruppo di Stefan Raunser presso l’MPI di Dortmund e co-primo autore della pubblicazione.
Le formine sono proteine altamente dinamiche che assemblano rapidamente i filamenti, quindi è difficile ottenere abbastanza estremità dei filamenti per una determinazione dettagliata della struttura. Gli scienziati dell’MPI hanno analizzato non solo una, ma tre distinte formine provenienti da funghi, topi e esseri umani, che allungano i filamenti di actina a velocità molto diverse.
“Una delle formine che abbiamo studiato è molto veloce e può essere considerata la Ferrari tra le formine, mentre un’altra formina si comporta più come un trattore”, ha osservato Stefan Raunser. Gli scienziati hanno testato e ottimizzato un’ampia varietà di condizioni che alla fine hanno fornito loro un numero elevato di filamenti legati alla formina.
“Ci siamo basati sull’esperienza acquisita dai nostri studi precedenti. L’ottimizzazione iterativa sia della biochimica che della preparazione del campione crio-EM è stata fondamentale per ottenere queste strutture”, ha detto Micaela Boiero Sanders, l’altra co-autrice dello studio.
Le nuove strutture, con risoluzioni intorno a 3,5 Ångstrom, mostrano che le formine circondano l’actina come un anello asimmetrico: una metà dell’anello è legata stabilmente, mentre l’altra metà è vagamente associata al filamento ed è libera di catturare una nuova subunità: “L’analisi delle strutture ci ha regalato un vero momento ‘Eureka’ per quanto riguarda il meccanismo”, hanno affermato Oosterheert e Boiero Sanders.
Differenze di velocità tra i complessi actina-formina
Introducendo mutazioni nelle formine, gli scienziati dell’MPI hanno anche spiegato le differenze di velocità tra i complessi actina-formina: se l’anello di formina è legato più strettamente all’estremità del filamento di actina, è più difficile per l’anello lasciarsi andare e salire su un nuovo, subunità di actina in arrivo. Di conseguenza, la crescita del filamento è più lenta.
“Ora capiamo come una forma che si comporta come un trattore possa essere resa più veloce dotandole di alcune caratteristiche simili a quelle della Ferrari“, ha evidenziato Peter Bieling.
Il team dell’MPI prevede che i risultati saranno utili ai numerosi scienziati di tutto il mondo che studiano il citoscheletro di actina: “Le nostre nuove conoscenze aprono un gran numero di possibilità per chiarire i ruoli specifici delle quindici formine umane a livello cellulare, il che può aumentare la nostra comprensione di come le mutazioni nei geni della formina portano a malattie gravi”, ha concluso Raunser.