- Un infarto del miocardio si verifica quando una parte del muscolo cardiaco non riceve abbastanza sangue. Più tempo passa senza che venga ripristinato il flusso sanguigno, maggiore è il danno al muscolo cardiaco.
- Cellule progenitrici cardiache invece di cellule cardiache differenziate
- Meccanismi molecolari complessi
- Trattamento di successo dei cuori di maiale
- I ricercatori mirano ad avviare studi clinici entro i prossimi due anni
Un infarto del miocardio si verifica quando una parte del muscolo cardiaco non riceve abbastanza sangue. Più tempo passa senza che venga ripristinato il flusso sanguigno, maggiore è il danno al muscolo cardiaco.
La causa più comune di infarto è la malattia coronarica. Un altro motivo, anche se meno frequente, è un forte spasmo, o costrizione improvvisa, di un’arteria coronaria, che può interrompere l’afflusso di sangue al muscolo cardiaco.
Il corpo umano non è in grado di ricostruire il tessuto danneggiato in seguito ad un infarto a causa dell’incapacità del cuore di produrre nuovi miocardiociti. Il trattamento con cellule progenitrici cardiache, tuttavia, potrebbe portare alla produzione di cellule cardiache funzionali nelle regioni danneggiate. Un team interuniversitario ha introdotto questo nuovo metodo di trattamento illustrandolo in Nature Cell Biology lo scorso mese. Gli studi clinici dovrebbero iniziare entro i prossimi due anni.
Quando le cellule muscolari cardiache muoiono a causa di un infarto o di qualsiasi altra ragione, vengono sostituite da tessuto cicatriziale fibrotico, che peggiora la funzione cardiaca. Alcuni animali, in particolare anfibi e pesci, possono curare tali ferite, un talento che manca quasi del tutto al cuore di un essere umano adulto. Il trattamento con cellule staminali è una strategia sperimentale per rigenerare il tessuto cardiaco mancante. Ricerche precedenti utilizzavano cellule cardiache derivate da cellule staminali, in particolare cardiomiociti. Tuttavia, si sono verificati numerosi effetti collaterali, inclusi battiti cardiaci anormali e aritmie mortali.
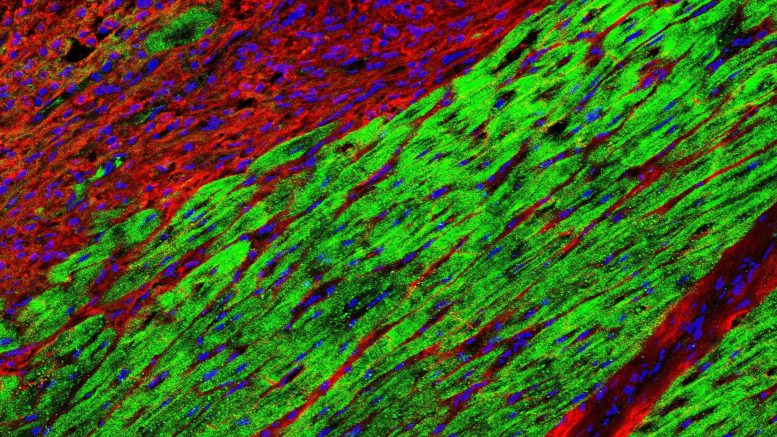
Una sezione di tessuto mostra che già dopo quattordici giorni le cellule progenitrici cardiache (verdi) colonizzano quasi completamente le aree danneggiate del cuore. Credito: Poch et al., Biologia cellulare naturale
Cellule progenitrici cardiache invece di cellule cardiache differenziate
Per queste ragioni, il team che lavora con Karl-Ludwig Laugwitz, professore di cardiologia al TUM, sta studiando le cellule progenitrici ventricolari umane. Queste cellule svolgono un ruolo cruciale nella formazione del cuore durante lo sviluppo. Nel tempo, si differenziano nei vari tipi cellulari del cuore, compresi i cardiomiociti. Il team è riuscito a produrre un gran numero di tali HVP da cellule staminali pluripotenti embrionali umane. “Questo rappresenta il culmine di due decenni del nostro lavoro cercando di trovare la cellula ideale per ricostruire il cuore“, afferma Kenneth R. Chien, professore di ricerca cardiovascolare al Karolinska Institutet.
Tre le cattedre TUM coinvolte: Prof. Karl-Ludwig Laugwitz (a destra), Prof. Alessandra Moretti (2a da destra) e Prof. Christian Kupatt-Jeremias (a sinistra) con il primo autore Dr. Christine M. Poch. Credito: Daniel Delang / TUM
Meccanismi molecolari complessi
Con queste cellule, gli scienziati hanno studiato i complessi processi molecolari coinvolti nella riparazione delle aree danneggiate del muscolo cardiaco. “Nelle indagini di laboratorio, siamo stati in grado di mostrare come gli HVP possono, in un certo senso, rintracciare le regioni danneggiate del cuore, migrare verso i siti della lesione e maturare in cellule cardiache funzionanti. Inoltre prevengono attivamente la formazione di tessuto cicatriziale dialogando con i fibroblasti, come chiamiamo le cellule che formano la struttura strutturale per il tessuto connettivo non funzionale“, afferma il Prof. Laugwitz, che dirige il Primo Dipartimento di Medicina del Klinikum Rechts di TUM der Isar.
Trattamento di successo dei cuori di maiale
Come passaggio successivo, il team interdisciplinare ha utilizzato i maiali per studiare l’efficacia del trattamento di un cuore danneggiato con gli HVP. Fisiologicamente, i cuori di maiale sono abbastanza simili a quelli degli umani. Di conseguenza, gli esperimenti con i maiali vengono spesso condotti poco prima dell’inizio degli studi su pazienti umani. I risultati mostrano che i danni al cuore possono essere riparati in modo affidabile anche in animali di grandi dimensioni senza che siano osservati gravi effetti collaterali. “Il trattamento ha dimostrato con successo la formazione di nuovo tessuto cardiaco e, soprattutto, il miglioramento della funzione cardiaca e la riduzione del tessuto cicatriziale“, afferma la dott.ssa Regina Fritsche-Danielson, responsabile della ricerca e dello sviluppo precoce di AstraZeneca.
I ricercatori mirano ad avviare studi clinici entro i prossimi due anni
Nei prossimi mesi e anni, gli scienziati hanno in programma di tradurre i loro attuali risultati di ricerca per sviluppare un trattamento per i pazienti cardiopatici. Un importante passaggio intermedio nello sviluppo di linee ipoimmunogene di HVP. Attualmente, è necessario inattivare il sistema immunitario del ricevente per evitare che distrugga il trattamento cellulare. Le cellule ipoimmunogene eliminerebbero la necessità di questo passaggio perché non sarebbero identificate come corpi estranei al ricevente. Ulteriori ricerche saranno condotte sulle cellule ipoimmunogene e sui possibili effetti collaterali. L’obiettivo è avviare studi clinici sull’uso terapeutico degli HVP entro i prossimi due anni.
“Le nuove intuizioni sull’uso terapeutico degli HVP rappresentano una pietra miliare nel trattamento di diversi pazienti con grave insufficienza cardiaca”, afferma il Prof. Karl-Ludwig Laugwitz. “Soprattutto i pazienti più anziani con condizioni coesistenti, per i quali un intervento chirurgico al cuore importante rappresenterebbe uno sforzo eccessivo, trarrebbero beneficio dal trattamento con HVP“.
Riferimento: “Migratory and anti-fibrotic programmes define the regenerative potential of human cardiac progenitors” di Christine M Poch, Kylie S Foo, Maria Teresa De Angelis, Karin Jennbacken, Gianluca Santamaria, Andrea Bähr, Qing-Dong Wang, Franziska Reiter, Nadja Hornaschewitz, Dorota Zawada, Tarik Bozoglu, Ilaria My, Anna Meier, Tatjana Dorn, Simon Hege, Miia L. Lehtinen, Yat Long Tsoi, Daniel Hovdal, Johan Hyllner, Sascha Schwarz, Stefanie Sudhop, Victoria Jurisch, Marcella Sini, Mick D. Fellows, Matthew Cummings, Jonathan Clarke, Ricardo Baptista, Elif Eroglu, Eckhard Wolf, Nikolai Klymiuk, Kun Lu, Roland Tomasi, Andreas Dendorfer, Marco Gaspari, Elvira Parrotta, Giovanni Cuda, Markus Krane, Daniel Sinnecker, Petra Hoppmann, Christian Kupatt, Regina Fritsche-Danielson, Alessandra Moretti, Kenneth R. Chien e Karl-Ludwig Laugwitz,12 maggio 2022,Biologia cellulare della natura .
DOI: 10.1038/s41556-022-00899-8